El desarrollo de las herramientas basadas en CRISPR para editar el genoma les sirvió a las investigadoras Jennifer Doudna y Emmanuelle Charpentier para ganar el Premio Nobel de Química en 2020.
Menos de un año después, se acaban de dar a conocer los primeros datos de un ensayo clínico que está usando esa misma tecnología para tratar una enfermedad rara y mortal inactivando el gen responsable. Con un añadido decisivo: por primera vez se ha usado inyectando la herramienta directamente en la sangre de los pacientes, lo que hace que pueda viajar por todo su cuerpo.
Lucila Anuncio - UBICACION: Articulo
"Es un primer paso fundamental para poder inactivar, reparar o reemplazar cualquier gen que cause enfermedades, en cualquier parte del cuerpo", afirma Jennifer Doudna en la revista 'Science'.
La enfermedad que trataban de curar es amiloidosis por transtiretina, más conocida como ATTR. Una amiloidosis se produce cuando una proteína anormal (llamada amiloide) se acumula en ciertos órganos del cuerpo e impide que funcionen correctamente.
En este caso, la transtiretina (TTR) es una proteína que se produce en el hígado, pero en los pacientes de ATTR está mutada y se acumula de forma tóxica en el corazón y en los nervios. El resultado es mortal por fallos cardíacos o nerviosos: algunas personas fallecen apenas dos años después de recibir el diagnóstico. Otras tienen más suerte y puede sobrevivir algunos lustros.
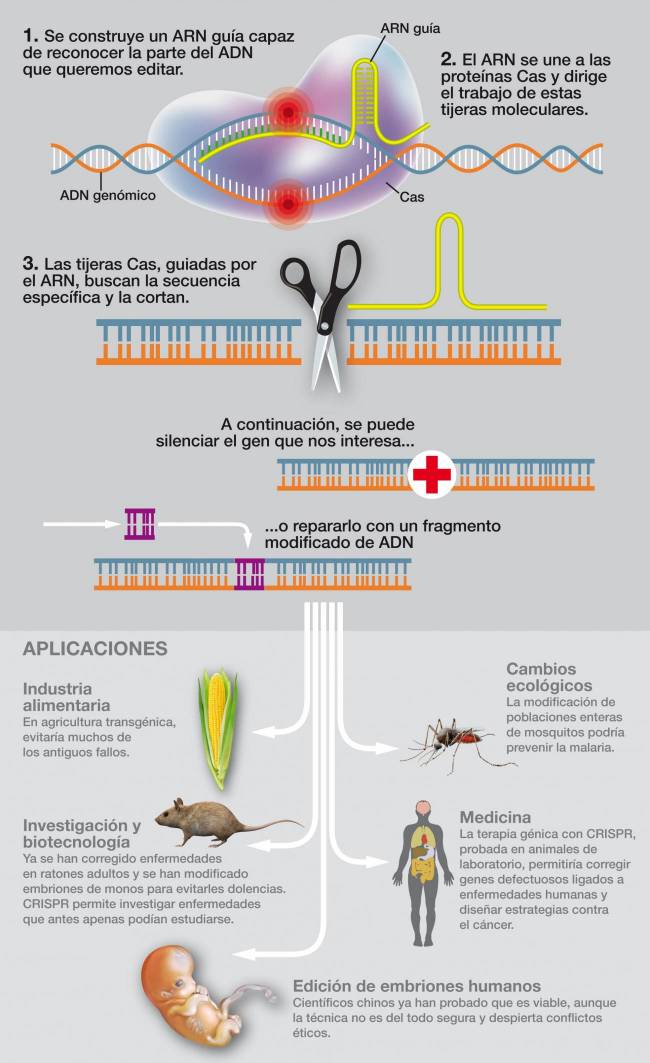
En este estudio, desarrollado por la farmacéutica Regeneron e Intellia Therapeutics ('startup' impulsada por la propia Jennifer Doudna), la idea era acabar con el problema inactivando el gen que produce la transtiretina. En el ensayo clínico en fase 1 solo participaron seis pacientes con ATTR, cuatro hombres y dos mujeres de entre 46 y 64 años. Después de tan solo 28 días, los niveles de transtiretina habían caído entre un 80% al 96%. De esta forma, la inyección mejora los resultados del único medicamento aprobado para esta enfermedad y que también trata de eliminar esa proteína, llamado patisirán. ¿Qué lleva exactamente esa inyección capaz de acabar con el gen que produce la TTR? ¿Cómo funciona? Eso es lo relevante, más allá del resultado, que aún es muy limitado y para un caso muy concreto. La tecnología CRISPR es capaz de cortar un gen. En concreto, la proteína Cas hace el corte y la célula pone en marcha la maquinaria de reparación del ADN para subsanar la herida, pero el gen en cuestión ya no puede ejercer su función.
Cómo funciona en el cuerpo humano
Todo eso se conoce desde hace años, pero ¿cómo hacer que funcione dentro del cuerpo humano y no en simples experimentos 'in vitro'? Estos investigadores lo han resuelto con ARN mensajero envuelto en nanopartículas lipídicas. Es justo la misma tecnología que utilizan las vacunas de ARN del covid (Pfizer y Moderna). En el caso de las vacunas, el ARN es la información genética que lleva las instrucciones para que las células fabriquen la proteína S del coronavirus, que servirá de antígeno. En este caso, hay dos tipos de ARN: uno sirve para sintetizar la proteína Cas que hará el corte; otro, para dirigirlo específicamente al gen que produce la TTR. Estamos ante la unión de dos de las biotecnologías más revolucionarias de los últimos años, CRISPR y el ARN mensajero envuelto en partículas lipídicas, con posibilidades que no hemos hecho más que comenzar a atisbar. “Estamos viviendo una explosión de novedades y esta es una de ellas”, afirma Lluis Montoliú, investigador del Centro Nacional de Biotecnología (CNB-CSIC) y uno de los mayores expertos españoles en edición genética. Por eso, comparte la emoción de Jennifer Doudna: “Es la primera vez que se administra un reactivo CRISPR 'in vivo'”, destaca en declaraciones a Teknautas.
Por qué este estudio es único
De hecho, hay 47 ensayos clínicos con tecnología CRISPR, pero todos salvo dos consisten en extraer células del paciente (principalmente, glóbulos blancos de la sangre), hacer la modificación fuera del paciente y volver a infundírselas. La mayor parte de estas investigaciones tienen que ver con la inmunoterapia del cáncer. Por ejemplo, inactivan el gen PD1 para que el sistema inmunitario reaccione de forma más fuerte contra las células tumorales. El único ensayo con CRISPR, además del publicado en NEJM, que puede considerarse 'in vivo' es una investigación sobre amaurosis congénita de Leber, un problema de la retina que provoca ceguera. Sin embargo, en ese caso, la inyección se aplica directamente en el ojo, que al ser parte del cerebro está separado del resto del cuerpo por la barrera hematoencefálica, con lo cual, las sustancias que se le administran no pasan al torrente sanguíneo ni a otros órganos.

Por el contrario, el estudio sobre ATTR “es el primero que se administra sistémicamente a través de vía intravenosa y esto es muy relevante”, asegura Montoliú. Además, la apuesta por las nanopartículas lipídicas está marcando el camino para conseguir llevar la tecnología CRISPR donde quieran los investigadores. Son gotitas de lípidos mezcladas con otras moléculas que llevan el producto terapéutico a las células de destino. No se sabe cuál es su composición exacta, igual que tampoco se conocen los detalles de las que emplean las vacunas de Pfizer o Moderna, porque “es la fórmula de la Coca-Cola”, apunta el biotecnólogo. Sin embargo, está claro que han conseguido llevar la tecnología CRISPR a las células hepáticas. Esta vez, el hecho de que la proteína que se quería eliminar se produzca en el hígado era una ventaja, porque “cualquier cosa que metas en la sangre va a acabar en el hígado, que es una gran esponja”. No obstante, los expertos creen que, usando el mismo método, pueden alcanzar cualquier otro órgano. Si se le puede poner alguna pega a la investigación es que, de momento, los resultados incluyen a muy pocos pacientes. En cualquier caso, confirman los datos experimentales en animales (ya avanzados en 2018 por la revista 'Cell Reports'), que indicaban que una sola dosis era suficiente para mantenerlos a salvo de la enfermedad un año más tarde de la inyección. Ahora, agregarán más pacientes al estudio y los seguirán durante más tiempo “para ver si se confirman estos resultados preliminares que son tan esperanzadores”.
Lecciones para el futuro de la edición de genes
Una lección que deja este trabajo es que la edición de genes, de momento, no va a ser como nos habían contado, pero aun así, va a ser un avance fabuloso. “Los investigadores hemos contado que CRISPR serviría para corregir secuencias, para editar, para cambiar la letra incorrecta y poner la correcta”, apunta el experto, pero “en realidad la aplicación que está triunfando es la más básica, la inactivación de genes, que no pretende resolver una mutación, sino que un gen deje de expresarse, con el consiguiente resultado terapéutico”. El problema de “editar” realmente los genes, cambiando una secuencia incorrecta por la correcta, es que “todavía no lo controlamos”, pero es una posibilidad que sigue estando ahí. “A mí me nace un ratón de cada 20 con la secuencia correcta”, reconoce Montoliú, que trabaja con estas herramientas orientadas al estudio de otra enfermedad rara, el albinismo. Por eso, aún no se puede aplicar al ser humano. El estudio de Regeneron y de Intellia demuestra que la vía de inactivar genes es mucho más segura. “Si finalmente se convierte en un tratamiento aprobado por las agenciar reguladoras, va a llevar esta tecnología que de otra manera podrían morir o estar condenados a tratamientos crónicos poco satisfactorios y con consecuencias”, explica. Una de las preguntas que se pueden plantear es si la inactivación del gen no tiene otras consecuencias sobre el organismo. “El TTR ayuda al transporte de la vitamina A y de la tiroxina, pero podemos compensar su eliminación. Por ejemplo, se puede aumentar la cantidad de vitamina A en la dieta. Hasta cierto punto, los problemas asociados no representan un gran obstáculo”, explica el investigador del CNB-CSIC.
Con la tecnología de edición genética hay una preocupación más profunda. Si la tecnología que se utiliza para inactivar un gen no es lo suficientemente precisa, ¿puede eliminar también otros genes que sean parecidos? En teoría, esto podría suceder, provocando mutaciones en otras partes del genoma y, por lo tanto, cáncer. Sin embargo, esta investigación resuelve muy bien el problema. “Siempre puede haber otros genes que tengan secuencias parecidas, pero en este caso, los experimentos 'in vitro' demostraron que los errores eran muy limitados y que la guía hacia el gen era la mejor”, comenta. Técnicamente, no se puede decir que sea la primera vez que un tratamiento médico cambia nuestras características genéticas, porque desde los años 90 existen las terapias génicas para varios usos. La diferencia es que con esa metodología “no se pretende corregir la mutación, sino que añade una copia funcional que no se integra en el genoma”. En cambio, ahora estamos ante “una nueva ruta terapéutica con unas herramientas extraordinariamente versátiles”.
El talón de Aquiles de la tecnología CRISPR sigue siendo la sustitución y corrección. En teoría, aparte de llevar la proteína Cas para que corte el gen que interesa, podría trasladarse también un “ADN molde” para corregir un gen. Académicamente, se hace en los laboratorios, pero en la clínica aún no se ha logrado. Si la tecnología de Regeneron e Intellia llega a conseguirlo a través del ARN mensajero y las nanopartículas lipídicas, “abriría la posibilidad de aplicarla a otras enfermedades para las cuales no sería útil inactivar un gen, sino corregirlo”. Con este y otros avances en la edición genética, “podemos llegar potencialmente a un buen número de enfermedades que podrían ser tratadas. Evidentemente, cada una de ellas tendrá que ser investigada por separado, con sus ensayos clínicos correspondientes, como en este caso, pero todo es empezar. Han abierto una puerta que va a permitir la entrada de muchas apuestas terapéuticas creíbles para otras enfermedades”, afirma Montoliú. Las expectativas son excelentes.
Fuente: Diario El Confidencial








.png)